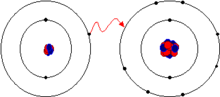
La ionización es el proceso químico o físico mediante el cual se producen iones, estos son átomos o moléculas cargadas eléctricamente debido al exceso o falta de electrones respecto a un átomo o molécula neutro. A la especie química con más electrones que el átomo o molécula neutros se le llama anión, y posee una carga neta negativa, y a la que tiene menos electrones catión, teniendo una carga neta positiva. Hay varias maneras por las que se pueden formar iones de átomos o moléculas.
ejemplo:
Sn F4
Sn +4 4F-1
SnF4 ----------------Sn+4 4F-1
SOLVATACION :
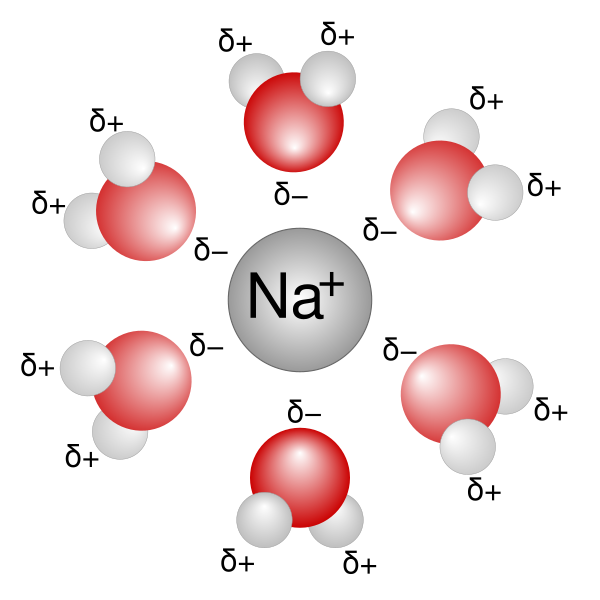
La solvatación es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
ejemplo:
CONDUCTIVIDAD:
Se define como la capacidad que tienen las sales inorgánicas en solución ( electrolitos ) para conducir la corriente eléctrica.
El agua pura, prácticamente no conduce la corriente, sin embargo el agua con sales disueltas conduce la corriente eléctrica. Los iones cargados positiva y negativamente son los que conducen la corriente, y la cantidad conducida dependerá del número de iones presentes y de su movilidad.
En la mayoría de las soluciones acuosas, entre mayor sea la cantidad de sales disueltas, mayor será la conductividad, este efecto continúa hasta que la solución está tan llena de iones que se restringe la libertad de movimiento y la conductividad puede disminuir en lugar de aumentas, dándose casos de dos diferentes concentraciones con la misma conductividad.
El agua pura, prácticamente no conduce la corriente, sin embargo el agua con sales disueltas conduce la corriente eléctrica. Los iones cargados positiva y negativamente son los que conducen la corriente, y la cantidad conducida dependerá del número de iones presentes y de su movilidad.
En la mayoría de las soluciones acuosas, entre mayor sea la cantidad de sales disueltas, mayor será la conductividad, este efecto continúa hasta que la solución está tan llena de iones que se restringe la libertad de movimiento y la conductividad puede disminuir en lugar de aumentas, dándose casos de dos diferentes concentraciones con la misma conductividad.
La conductividad, tal como se aplica al análisis de agua, es una medida de la capacidad del agua para conducir corriente eléctrica y está directamente relacionada con la concentración de sustancias ionizadas en el agua. Una vez que se han establecido correlaciones entre los valores de la conductancia y las normas características del sistema que se está supervisando, se convierte en una medida útil para manejar el procesamiento del agua. Dependiendo de la aplicación en particular, un cambio en la conductividad puede ser señal de cosas tales como la necesidad de añadir productos químicos o de regenerar el sistema
:
Sn+4 4f-1
anodo catodo
f-1 -1e -----f Sn+4+4e-----Sn
4f-4 - 4e-----4f
oxidacion reduccion